关键词 生豆粕;胰蛋白酶抑制剂;混合发酵
豆粕是畜禽最重要的植物性蛋白源,其中粗蛋白含量高达43%~48%,并有较平衡的氨基酸组成,尤其是其它植物性饲料易缺的赖氨酸,其含量高达2.5%~2.8%[1]。但是,豆粕中还存在多种抗营养因子,极大地影响了豆粕的饲用价值。胰蛋白酶抑制剂(Trypsin Inhibitors;简称TI)是豆粕中主要的抗营养因子,在豆粕中的含量为2%左右[2]。TI能阻碍肠道内蛋白水解酶的作用而使蛋白质消化率下降,引起恶心、呕吐等肠胃中毒症状;另一方面TI还作用于胰腺本身,刺激胰腺分泌过多的胰腺酶,造成蛋白质内源代谢损失,导致动物出现消化吸收功能失调或紊乱,抑制了机体的生长[4];另外,由于胰脏大量地制造胰蛋白酶,可造成胰脏肿大中毒等现象[5]。
热处理生豆粕可以有效地破坏TI分子结构,但是,热加工处理工艺复杂,能源消耗大,而且加热不够,不能消除抗营养因子,加热过度则会破坏饲料中的氨基酸和维生素,加热过程还会引起氨基酸与碳水化合物反应,如赖氨酸与还原糖反应生成不溶性复合物,导致蛋白质消化率下降,降低饲料的营养价值,影响豆粕的利用率。
本文采用多菌种混合发酵法处理生豆粕,研究其最佳发酵工艺,以达到在不影响豆粕营养价值的情况下钝化去除TI的目的。
1 材料和方法
1.1 材料
1.1.1 菌种
酵母菌y-021,y-028,乳酸菌Lc均为本实验室筛选菌种。
1.1.2 培养基
种子培养基,麦芽汁培养基[6]。发酵基础培养基,豆粕45g/500ml广口瓶,料水比1:1,pH值自然。
1.2 方法
1.2.1 种子培养方法
将斜面菌种分别接一环于液体种子培养基中,于25℃,220r/min培养24h。
1.2.2 不同条件对豆粕发酵的影响
在发酵基础培养基的基础上,通过改变不同的发酵条件进行试验。
1.2.2.1 多菌株不同接种量对豆粕发酵的影响 采取酵母菌y-021,y-028,乳酸菌Lc3种菌混合发酵,进行各菌株不同接种量的正交试验。
1.2.2.2 含水量对豆粕发酵的影响 进行豆粕不同含水量试验,料水比分别为1:0.5,1:0.6,1:0.7,1:0.8,1:0.9,1:1.0,1:1.1,1:1.2,1:1.3。
1.2.2.3 通气量对豆粕发酵的影响 通气量通过不同的瓶装量来调节,500ml广口瓶装量分别为(干料重)15g,30g,45g,60g,90g。
1.2.2.4 发酵时间对豆粕发酵的影响 进行豆粕不同发酵周期的试验,发酵周期分别为36h,48h,60h,72h,84h。
1.2.2.5 pH值对豆粕发酵的影响 用缓冲液把培养基起始pH值分别调为2.3,4.6,7.0,9.0及pH值自然(自来水)。
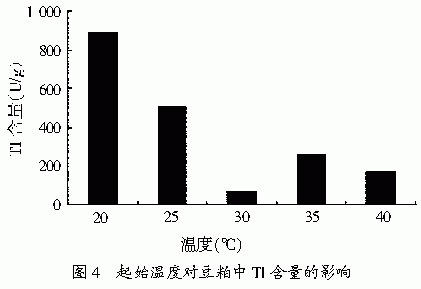
1.2.2.6 起始温度对豆粕发酵的影响 发酵温度分别为20℃,25℃,30℃,35℃,40℃。
1.2.3 测定方法
豆粕中胰蛋白酶抑制剂含量的测定,改进的PAPNA法[7]。
2 结果与分析
2.1 发酵条件试验
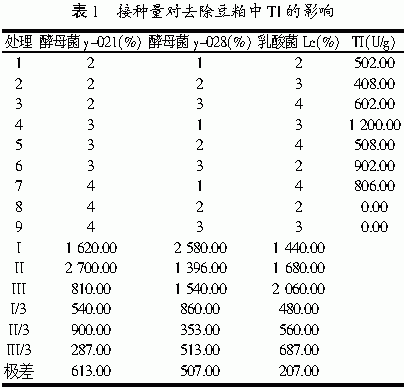
2.1.1 不同接种量对去除豆粕中TI的影响
接种量是与培养基利用率直接相关的参数。大的接种量尽管可以使生长快、周期短,但后期可能因缺乏营养而无法实现高的芽孢数;而接种量太少不仅对营养利用不充分,且发酵周期可能延长,染菌机率提高[8~9]。采用酵母菌y-021,y-028,乳酸菌Lc3种菌混合发酵,通过正交实验进行了不同接种量对去除TI的影响,结果如表1所示:3种菌对TI的分解效果,影响最大的为酵母菌y-021,其次是酵母菌y-028、乳酸菌Lc菌。所以要较好地分解胰蛋白酶抑制剂,需酵母菌y-021 4%、y-028 2%、Lc菌2%。
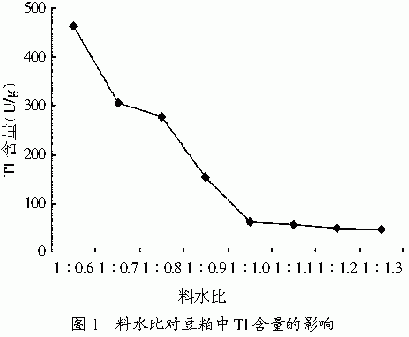
2.1.2 含水量对去除豆粕中TI的影响
与液体深层发酵不同,固体发酵的培养基含水量是一个很重要的参数,包被在固体基质表面的水膜溶解了微生物需要的无机盐和代谢产物,同时为微生物的生长提供所需的潮湿环境。另外,基质含水量还影响着培养系统中的氧气供应、气体流动等[10],它是关系到发酵成败的制约因素。不同含水量试验结果如图1所示:料水比为1:1~1:1.3的发酵对胰蛋白酶抑制剂的分解效果均较好。从实际生产考虑,选1:1作为最佳发酵料水比。
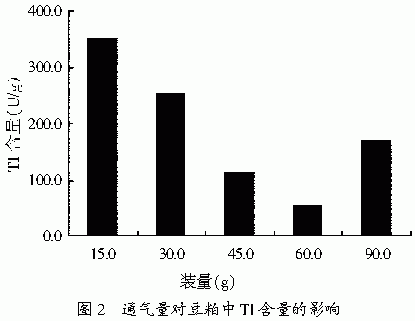
2.1.3 通气量对去除豆粕中TI的影响
通气量对豆粕中TI的去除有一定的影响,结果见图2。500ml广口瓶中干料装量为60g时,对豆粕中TI的分解效果最好。
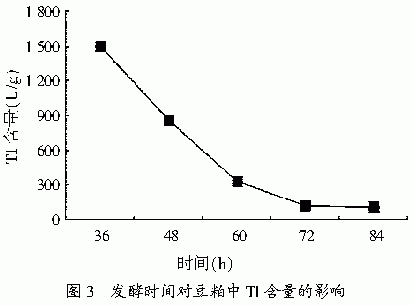
2.1.4 发酵时间对去除豆粕中TI的影响
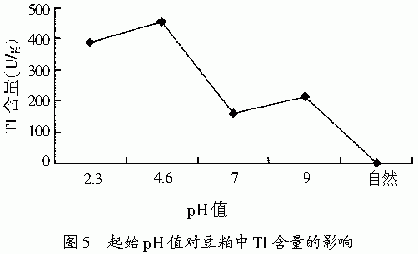
2.1.6 不同起始pH值对豆粕中胰蛋白酶抑制剂含量的影响
培养基的酸度对微生物的生命活动有很大影响,酸度过高或过低会影响微生物的新陈代谢正常进行。pH值可以影响细胞膜上的电荷,从而影响微生物对营养物质的吸收[11]。发酵基质不同的起始pH值对豆粕中TI的处理效果见图5,pH值为自然(自来水)时,对豆粕中TI的去除效果最佳。 3 结论 参考文献(略) |